近年来,双特异性抗体基于更为全面药物机理,显示更强临床及市场前面,成为全球抗体药物的关注的热点。目前全球已批准3个双特异性抗体药物(一个退市),截止到2019年3月约有85个项目处于临床阶段,120个左右的项目处于临床前。
按治疗领域分类,75%左右的为抗肿瘤项目,以CD3相关的双特异性抗体(BsTCEs,Bi-specific T-cell engagers)达到了158个,占到一半以上。CD3相关双抗一方面如CAR-T细胞治疗一样激活T细胞显示强劲疗效,另一方面又可以通过控制剂量解决CAR-T细胞治疗的毒性问题,可以说是目前从机理和结构上最有可能成功的双特异抗体项目。
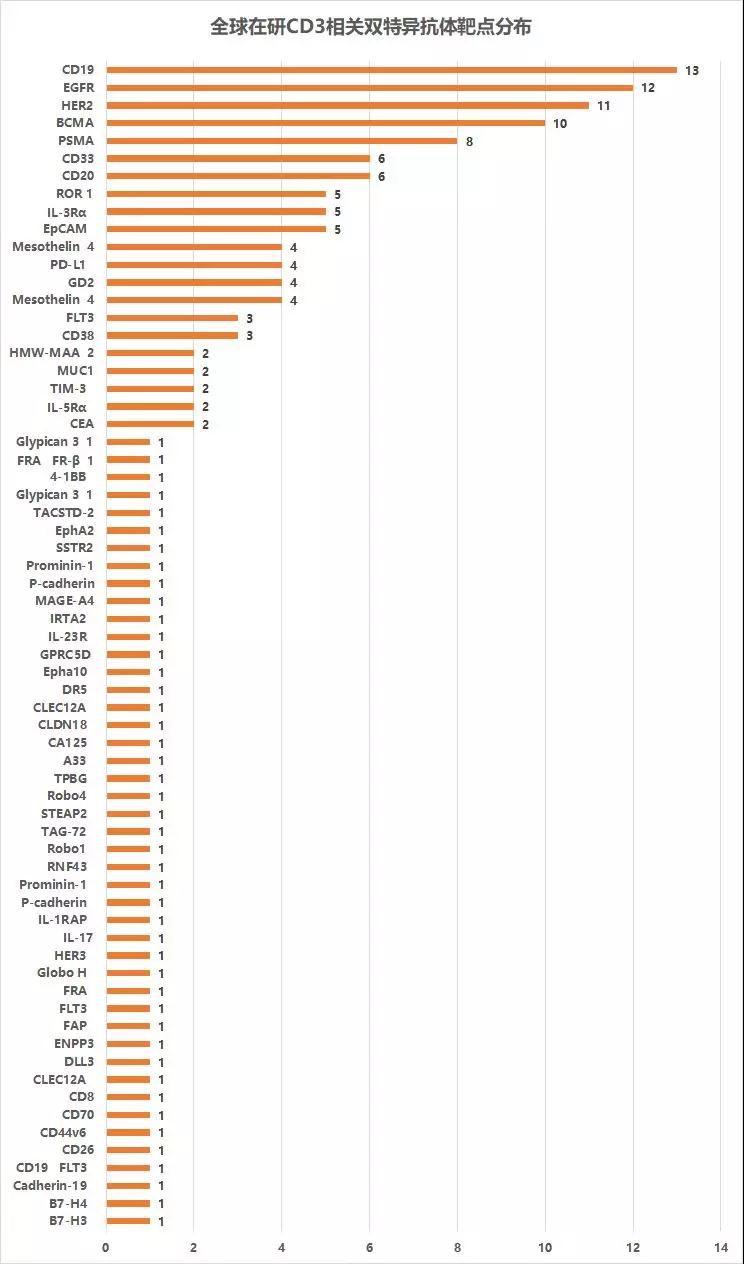
▲在研CD3双抗肿瘤相关抗原靶点分布
在目前在研的158个CD3相关双特异抗体中,CD19、EGFR、HER2、BCMA和PSMA等则是热门研发靶点。从靶点分布来看,如CAR-T一样主要还是血液瘤治疗为主。
基于以上对于双特异抗体研发状况的分析,看似整个BsTCEs研究集中在肿瘤相关抗原的靶点的选择,但其实另一臂CD3抗体的开发则是BsTCEs研究的基础。历史总是螺旋式的前进,1986年全球首个抗体药物OKT3所针对的靶点就是CD3,随后基于免疫原性的问题退市。今天当全球药物的关注目光投射到双抗药物研发时,我们发现开发的前提又是寻找一条更为理想的CD3抗体,历史总是螺旋式的发展。本文以站在全球双特异抗体研发的热潮前,对BsTCEs的相关研发进行总结。
CD3分子是T细胞的重要标志,由γ、δ、ε、ζ和η五种多肽链组成。CD3分子与TCR以非共价键结合形成TCR-CD3复合物,CD3抗体识别抗原表位位于CD3复合体的ε链,其主要功能是把TCR与抗原结合后产生的活化信号传递到细胞内,诱导T细胞活化。由于CD3在CD4、CD8等多种T细胞表面进行表达,偏向CD3复合体的ε链的抗体对于T细胞的激活作用更为显著,同时安全性也更高。
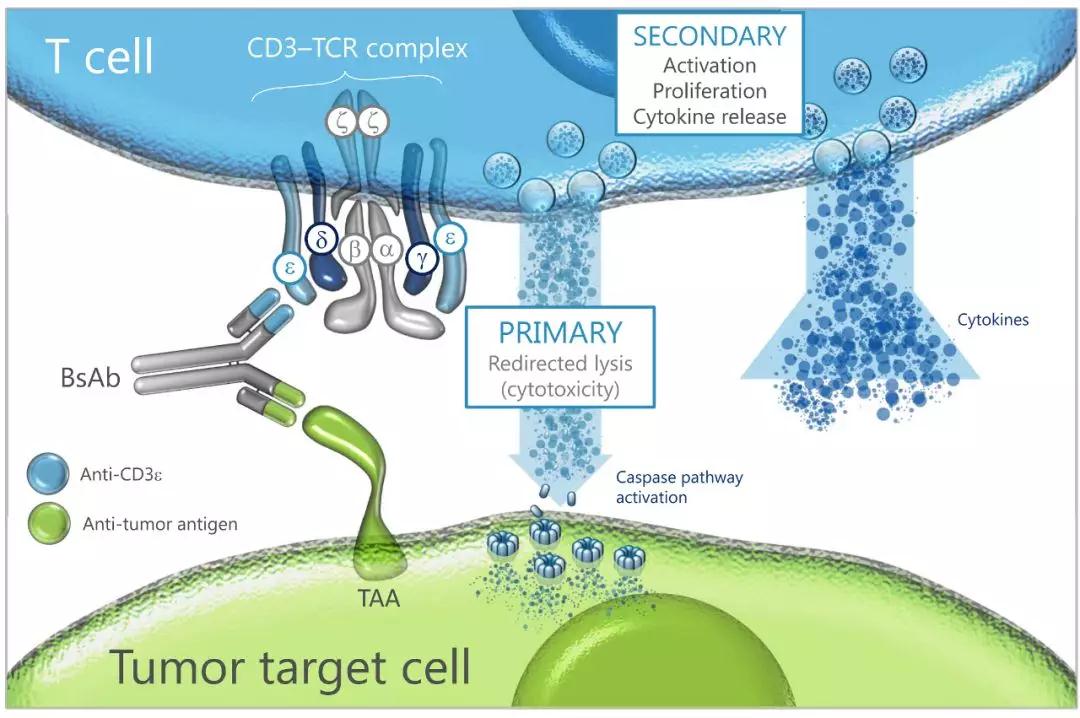
▲CD3双抗药物机理
CD3抗体识别所有T细胞,它和70%-80%的人外周血淋巴细胞和65%-85%的胸腺细胞发生反应。CD3抗体激活后的T细胞定向至肿瘤细胞周围,两种细胞接触进而形成突触,触发T细胞受体(TCR)信号通路的激活,颗粒酶表达、释放进而引起肿瘤细胞膜穿孔,导致后者的溶胞和凋亡。
TCR信号通路的激活同时引起一系列细胞因子的表达与释放,例如IL-2 的释放反馈刺激T细胞的增殖,放大免疫杀伤效应。临床前研究数据证明,在靶细胞存在下,双特异性抗体分子可有效激活T细胞,并刺激其增殖,同时引起靶细胞的死亡。
自OKT3以来,CD3相关抗体的研发层次不穷,但是真正符合BsTCEs开发的则极为有限,目前常用的公开CD3抗体都来自上世纪80年代的杂交瘤平台鼠源抗体,包括以下几种:OKT3、TR66、UCHT1、L2K和SP34等。它们在结构形式上各有差异,但由于其使用更为广泛,已经在有效性和安全性上得到了广泛的验证,对于新进研发者是个不错的选择。
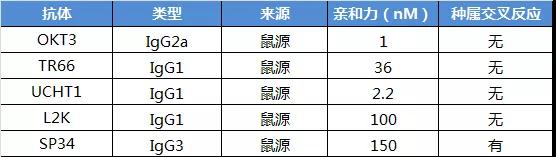
▲通用型CD3抗体相关结构参数
这几个通用抗体的头对头研究还比较有限,以目前有限的数据来看,UCHT1和L2K两个抗体在双抗组合中疗效更优一些。虽然OKT3退市后,进行过Fc端的优化,进行了L234A-L235A突变,减少了与FcγR结合,减少了补体c1q介导的细胞效应,提高了一定的安全性,但是其应用性仍然受到了一定的限制。所以后续BsTCEs直接分为了两个流派,一个是带Fc的,一个是非Fc的。Blinatumomab的结构即是非Fc的的结构,半衰期仅为2个小时,需要反复的注射,极大限制了其使用。因此对于后续BsTCEs来讲,减少Fc的效应功能,半衰期也是需要考虑的重要因素。
CD3单抗的种属相关性对CD3双抗的开发极为关键,SP34是目前为不多公开的可以和猴子具有种属反应的CD3抗体。基于这些因素大型药企及双抗平台型企业均开发了自主的CD3抗体,去年闪亮登场的WuXibody就拥有自主知识产权可以和猴子具有种属反应的CD3抗体。
Micromet是BsTCEs技术的领导者,早前BiTE系列抗体使用过多种CD3抗体进行比较,包括TR66等,但是首个项目Blinatumomab使用的是L2K07,很多研发机构曾误认为Blinatumomab使用的TR66。为了能和老鼠的CD3结合,Blinatumomab的大部分临床前试验使用的是替代的鼠源抗体muS103new。
Micromet被Amgen收购后,他们通过噬菌体展示方法进一步对L2K进行了人源化处理形成了diL2K,删除了潜在的T细胞抗原表位,其他后续平台项目均使用diL2K。相比于TR66和L2K可以公开使用,diL2K则被Amgen进行了专利保护。
CD3抗体对CD3复合体ε链的亲和力是BsTCEs是否成功的首个关键因素,这一点已经达成行业内共识。一方面是由于,为了模拟出T细胞的激活作用,CD3抗体需要相对低的亲和力,较高的Koff值。因为T细胞在体细胞的激活过程中,是依靠于T细胞的反复结合进行瀑布效应,形成成簇的T细胞,指数式地带动下游信号通路的变化。如果CD3抗体的亲和力过高,则只会与T细胞形成1:1的结合,很难引起群体T细胞的杀伤作用。另一方面则与组织分布有关,过高亲和力的CD3抗体可能将把双抗限制在脾脏等部位,难以接触到肿瘤。
几个通用型CD3抗体中,TR66的亲和力为36nM,而L2K的亲和力则为100nM。目前认为对于CD3双抗安全的亲和力范围为50-200nM,则不会在体内引起CD3介导的血浆清除,也不会将抗体限制于T细胞富集的组织中,影响BsTCEs的组织分布。当然目前在研的部分CD3双抗的亲和力低于这一范围,如罗氏的CD3抗体38E4v11亲和力高达0.032 nM,目前在前期研发过程仍然表现良好,说明这也需要结合具体项目具体分析。
CD3价键对于双抗功能也具有重要影响,在研BsTCEs单价CD3形式多价形式的。这主要是在之前的实验过程中,发现多价形式的CD3双抗可能会引起活化诱导T细胞死亡(AICD),造成非靶点依赖的T细胞激活,在没有结合肿瘤相关抗原情况激活T细胞引起副反应。CD3价键同样对于CD3抗体亲和力息息相关,对于单价CD3抗体而言,如上所述通常需要低亲和力的CD3抗体。而对于多价形式,则需要对肿瘤相关抗原具有高亲和力。
2018年5月罗氏在Clinical Cancer Research上发表文章对CD20-TCB抗体的药效和安全性进行了研究。罗氏的这种CD20-TCB包括2个anti-CD20 Fabs以及1个anti-CD3e Fab。一条臂上CD20 Fab直接与CD3e Fab进行融合,另一条臂上是一个单独CD20 Fab。其中CD20 Fab的序列来自已经上市的二代CD20抗体Obinutuzumab。Fc端经过突变去除绝大多数和Fcγ受体结合的能力,仅保留FcRn结合的能力,用以延长抗体的半衰期。抗体体外药效实验显示这种2:1非对称CD3双抗相对于1:1对称CD3双抗裂解肿瘤细胞的活性提高了40倍。
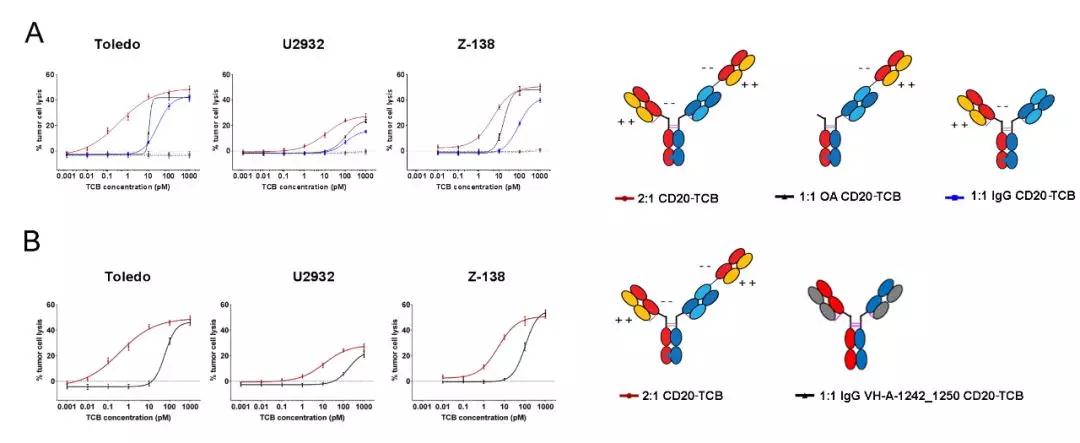
▲罗氏非对称性CD3双抗
今年初发表在《mAbs》上的一篇文献表明,Teneobio公司团队通过NGS技术筛选到12株具有相同裂解效力的CD3抗体,但是这12株抗体的活性确相差千倍。通过不同活性比较试验,最终确定了最大化肿瘤杀伤效应同时最小化细胞因子释放的CD3抗体,极大了提高了CD3双抗的治疗窗口。
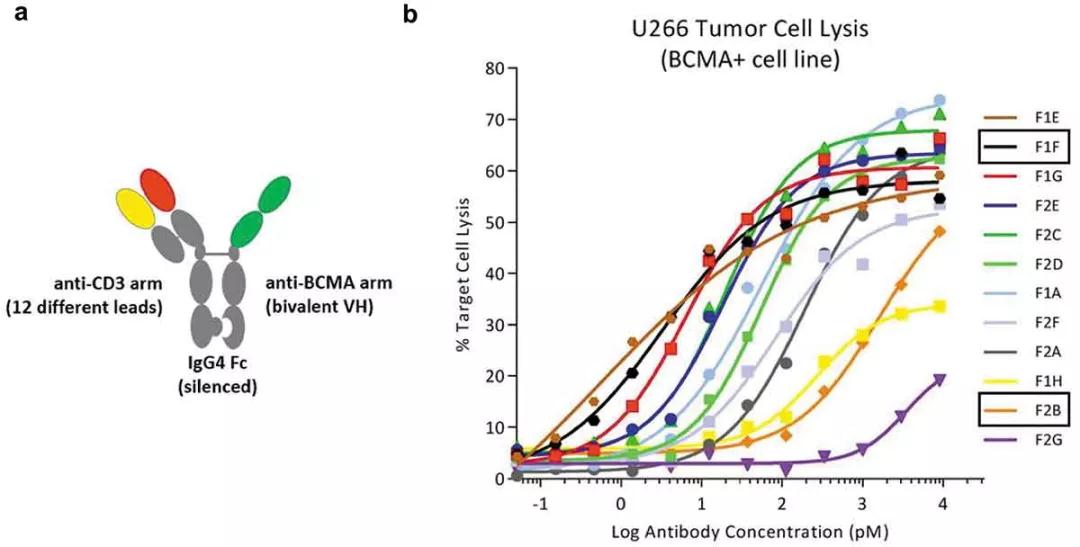
▲Teneobio的NGS技术助力CD3双抗的开发
双特异抗体药物的概念已经持续近40年,仍然处于早期阶段,相关治疗理念仍在早期转化过程中。因此对于CD3抗体的寻找或许仍旧是双抗走向成功的开端,对于亲和力和价键等研究仍需深入。
虽然行业见解在于,单抗重在靶点,双抗重在平台。但是笔者仍旧希望双抗的研发尽快走出平台建设,还有其他的工作仍需要完善。如笔者前文展现的,虽然目前BsTCEs的肿瘤相关靶点仍然较为集中,但是其他一些新型靶点已经显示一定的先进性,对于靶点的选择或者将是未来极为重要的工作。同时随着双特异抗体技术的不断成熟,其他形式抗肿瘤双抗或者如自身免疫等领域的双抗比例或许增多,而不是目前BsTCEs的一直独秀。
希望这一次双抗只是短暂地走失,而不是走丢。
参考文献
1.Bispecific antibodies: a mechanistic review of the pipeline
2.T cell engaging bispecific antibody (T-BsAb): from technology to therapeutics
3.MT110 A novel bispecific single-chain antibody construct with high efficacy in eradicating established tumors
4.Efficient tumor killing and minimal cytokine release with novel T-cell agonist bispecific antibodies。
5.CD20-TCB with obinutuzumab pretreatment as next generation treatment of hematological malignancies